La FDA accelera l'introduzione di piattaforme vaccinali saRNA una delle più grandi minacce biologiche della storia
Biotecnologie senza consenso: saRNA piattaforme vaccinali a RNA auto-amplificante
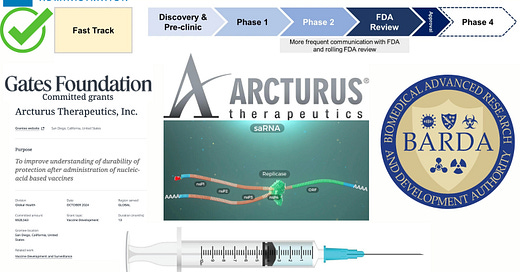
Nel novembre 2024, la FDA ha dato il via libera alla sperimentazione di Fase 1 per l'iniezione di influenza aviaria “pandemica” H5N1 (ARCT-2304) di Arcturus Therapeutics che si auto-amplifica (replicone):
Queste iniezioni sperimentali di repliconi sono finanziate principalmente dal BARDA con il sostegno della Fondazione Gates, che ha concesso ad Arcturus Therapeutics una sovvenzione di 928.563 dollari nell'ottobre 2024 per “migliorare la comprensione della durata della protezione dopo la somministrazione di vaccini a base di acidi nucleici”.
Ieri Arcturus Therapeutics ha ricevuto dalla FDA la designazione Fast Track per l'iniezione di repliconi ARCT-2304:
Secondo la FDA:
Il Fast Track è un processo progettato per facilitare lo sviluppo e accelerare la revisione di farmaci per il trattamento di patologie gravi e per soddisfare un bisogno medico insoddisfatto. Lo scopo è quello di far arrivare prima al paziente nuovi farmaci importanti.
Un farmaco che riceve la designazione Fast Track può beneficiare di alcuni o tutti i seguenti vantaggi:
Incontri più frequenti con l'FDA per discutere il piano di sviluppo del farmaco e garantire la raccolta dei dati appropriati necessari a supportare l'approvazione del farmaco
Comunicazioni scritte più frequenti da parte dell'FDA su aspetti quali il disegno degli studi clinici proposti e l'uso di biomarcatori
Ammissione all'approvazione accelerata e alla revisione prioritaria, se vengono soddisfatti i criteri pertinenti
Revisione continua, il che significa che un'azienda farmaceutica può sottoporre alla revisione dell'FDA le sezioni già completate della sua domanda di licenza biologica (BLA) o della domanda di nuovo farmaco (NDA), anziché aspettare che ogni sezione della NDA sia completata prima che l'intera domanda possa essere esaminata.
È importante capire che questi prodotti si comportano come un virus sintetico. L'mRNA del replicone è progettato per codificare non solo l'antigene bersaglio ma anche la replicasi virale, consentendo all'mRNA di replicarsi all'interno delle cellule bersaglio. Questo meccanismo di replicazione consente un periodo imprecisato di produzione di antigene tossico e una maggiore probabilità di shedding
Con un grave errore, la Commissione europea ha recentemente approvato le iniezioni di replicone mRNA COVID-19 (ARCT-154), sviluppato da Arcturus Therapeutics:
Come ho illustrato lo scorso anno, attualmente sono in fase di sviluppo almeno 33 candidati vaccini contro il samRNA
Ecco l'attuale cronologia delle approvazioni di iniezioni di mRNA autoamplificante:
FEB 2025 - L'UE approva il vaccino COVID-19 a samRNA (Arcturus Therapeutics - ARCT-154).
NOV 2024 - La FDA statunitense autorizza la sperimentazione del vaccino samRNA contro l'influenza aviaria H5N1 (Arcturus Therapeutics - ARCT - 2304).
NOV 2023 - Il Giappone approva completamente il vaccino COVID-19 samRNA (Arcturus Therapeutics - ARCT-154).
GIUGNO 2022 - L'India autorizza il primo vaccino COVID-19 samRNA per uso umano (Gennova Biopharmaceuticals - GEMCOVAC-19).
Il mese scorso ho detto al Dr. Drew e al suo pubblico che le iniezioni sperimentali di mRNA auto-amplificato rischiano di danneggiare in modo irreversibile la popolazione e dovrebbero essere interrotte.
È ormai evidente che l'industria farmaceutica e le agenzie di regolamentazione hanno un'attenzione pari a zero per gli enormi problemi di sicurezza legati alla replicazione di mRNA sintetici indefiniti che portano alla produzione incontrollata di antigeni tossici. Il fatto che la FDA abbia rilasciato la designazione Fast Track per un'iniezione sperimentale di replicone mRNA dell'influenza aviaria è profondamente preoccupante. Ci vorranno decenni per comprendere il profilo di sicurezza completo di questi prodotti genetici auto-amplificanti.
11 Apr 2025
Epidemiologo e amministratore della Fondazione McCullough
www.mcculloughfnd.org
Fonte/titolo originale: BREAKING: FDA Fast Tracks Self-Amplifying mRNA Bird Flu Injection
Segui @vocidallastrada anche su Telegram